배터리는 충·방전 과정에서 리튬이온이 양극과 음극 사이를 오가며 작동합니다. 충전 시에는 양극에서 빠져나온 리튬이온이 전해질을 통해 음극으로 이동해 저장되고, 방전 시에는 반대로 음극에서 양극으로 되돌아가 전류를 발생시키는 것이죠. 이때 리튬이온이 얼마나 원활하게 이동할 수 있는지를 나타내는 지표가 있는데요. 바로 ‘이온전도도’입니다. 이번 배터리 용어사전에서는 이온전도도에 대한 개념을 살펴보겠습니다!

이온전도도란?
이온전도도는 물질 내부에서 이온이 얼마나 원활하게 이동하여 전기를 생성하는지를 나타내는 지표입니다. 배터리에서는 전해질을 통해 리튬이온이 원활하게 이동하는 정도를 의미하고, 배터리의 기본적인 동작을 가능하게 하는 중요한 요소라고 볼 수 있습니다. 이온전도도 값은 전해질 속 이온의 농도, 전하량, 이동 특성에 따라 달라지게 됩니다.
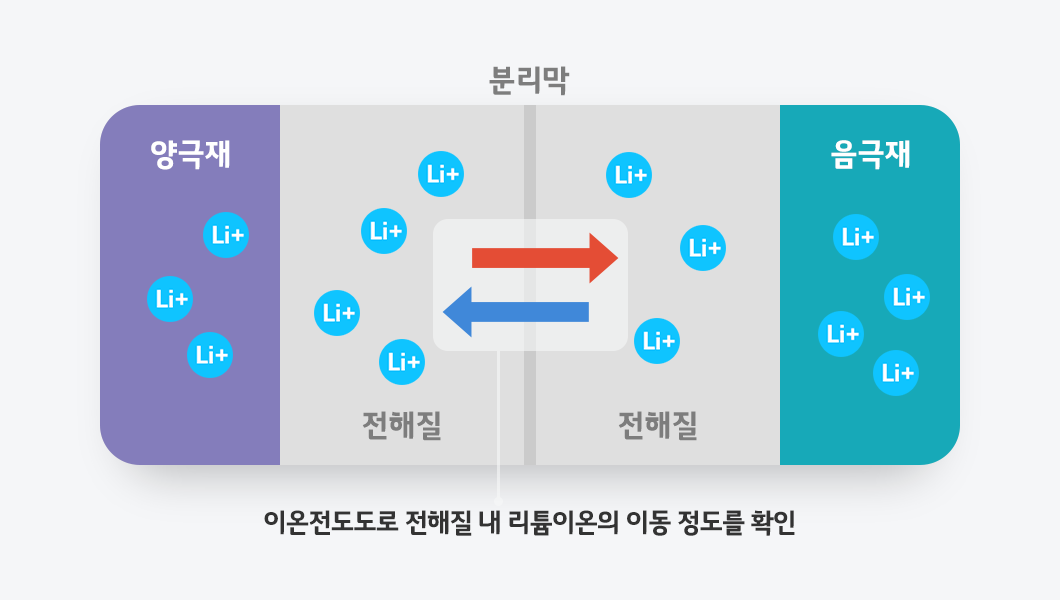
배터리에서 이온전도도의 중요성
이온전도도는 배터리 성능과 효율을 알아보는 데 있어서 중요한 역할을 합니다. 전해질은 리튬이온이 배터리의 양극과 음극 사이를 오가는 통로인데요. 이온전도도가 높을수록 전해질의 내부 저항이 낮아, 고출력 고속 충·방전이 가능해집니다. 반대로 이온전도도가 낮으면 이온이 느리게 이동해, 충·방전 속도가 저하되고 전압 강하가 발생하는데요. 이는 곧 배터리 출력과 수명의 저하로 이어지게 됩니다.
또한 이온전도도는 온도의 영향을 크게 받습니다. 온도가 올라가면 이온이 더 활발히 움직여 전도도가 높아지고, 반대로 낮아지면 전도도가 떨어집니다. 그래서 실제로 추운 환경에서는 배터리 성능이 감소하고, 따뜻한 환경에서는 충·방전이 원활해지는 특징이 나타납니다.

그렇다면 이온전도도가 높은 전해질의 조건은 무엇일까요?
이상적인 전해질은 이온을 잘 통과시키되 전자는 통과시키지 않는 특성을 가져야 하는데요. 여기에 높은 이온전도도와 거의 무시할 만큼 낮은 전자전도도를 동시에 갖추는 것이 중요합니다. 현재 상용화되는 액체전해질은 이온이 자유롭게 움직일 수 있어 충·방전이 빠르고 전류를 크게 흘릴 수 있습니다. 반면 차세대 전지로 불리는 전고체전지의 고체전해질은 액체전해질 대비 이온의 이동 통로가 제한적인데요. 이는 고체의 밀도가 액체보다 높고, 고체 내 이온은 결정 격자를 통과하여 움직여야 하기 때문에, 이온의 움직임이 상대적으로 제한되기 때문입니다. 이에 상온에서도 액체전해질만큼 이온전도도가 높은 고체전해질을 개발하는 것이 차세대 배터리 개발에 있어서 중요한 과제로 꼽히고 있죠.
*전해질이란? 리튬이온의 출퇴근 수단, 전해질 보러가기
이온전도도를 측정하는 전기화학 임피던스 분광법(EIS)
전기화학 임피던스 분광법(Electrochemical Impedance Spectroscopy, EIS)은 배터리 전해질의 이온전도도를 측정하는 대표적인 방법입니다. 아주 작은 교류 신호를 전해질에 흘려보내고, 이에 대한 전기적 반응을 분석해 전해질의 저항을 계산합니다. 특히 이온은 통과시키되 전자는 막는 전극을 사용하면, 측정된 저항값에서 전해질 속 이온의 이동 특성을 확인할 수 있습니다.
이렇게 얻은 저항값(R)과 시료의 두께(l), 전극 면적(A)을 이용해 아래 식을 통해 이온전도도의 값을 계산할 수 있습니다.
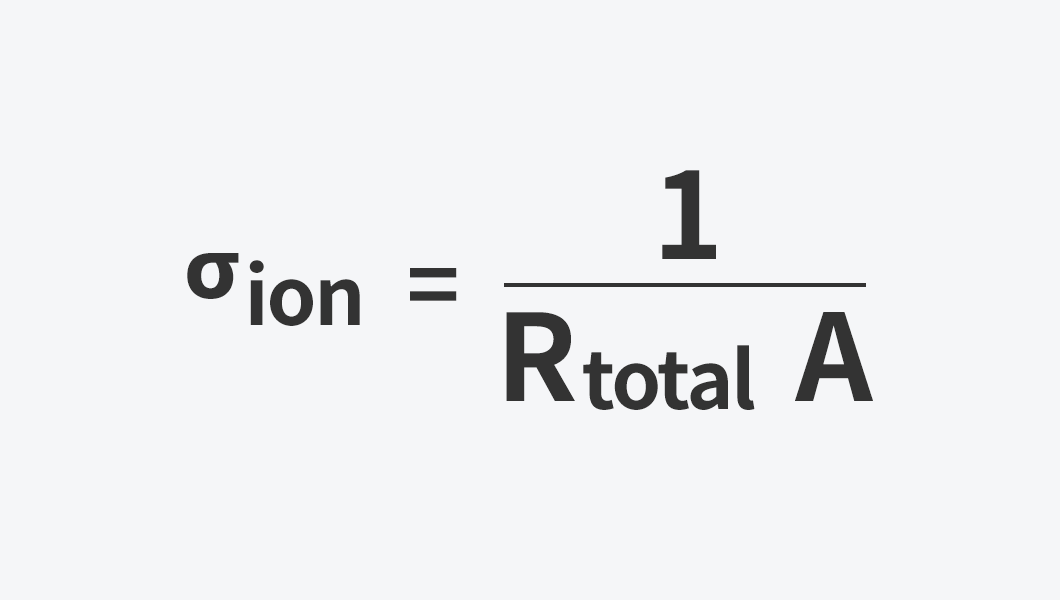
이 방법은 전해질 자체의 저항과 전극-전해질 계면 저항을 구분해서 볼 수 있다는 장점이 있어 배터리 연구에 널리 활용되고 있습니다.
이처럼 이온전도도는 배터리 성능을 개선하기 위해 반드시 알아야 할 개념이며, 차세대 배터리에서도 이온전도도를 높이기 위한 다양한 연구가 활발히 이뤄지고 있습니다. 다음 시간에도 배터리의 기초 개념을 쉽고 흥미롭게 풀어드리겠습니다.





